
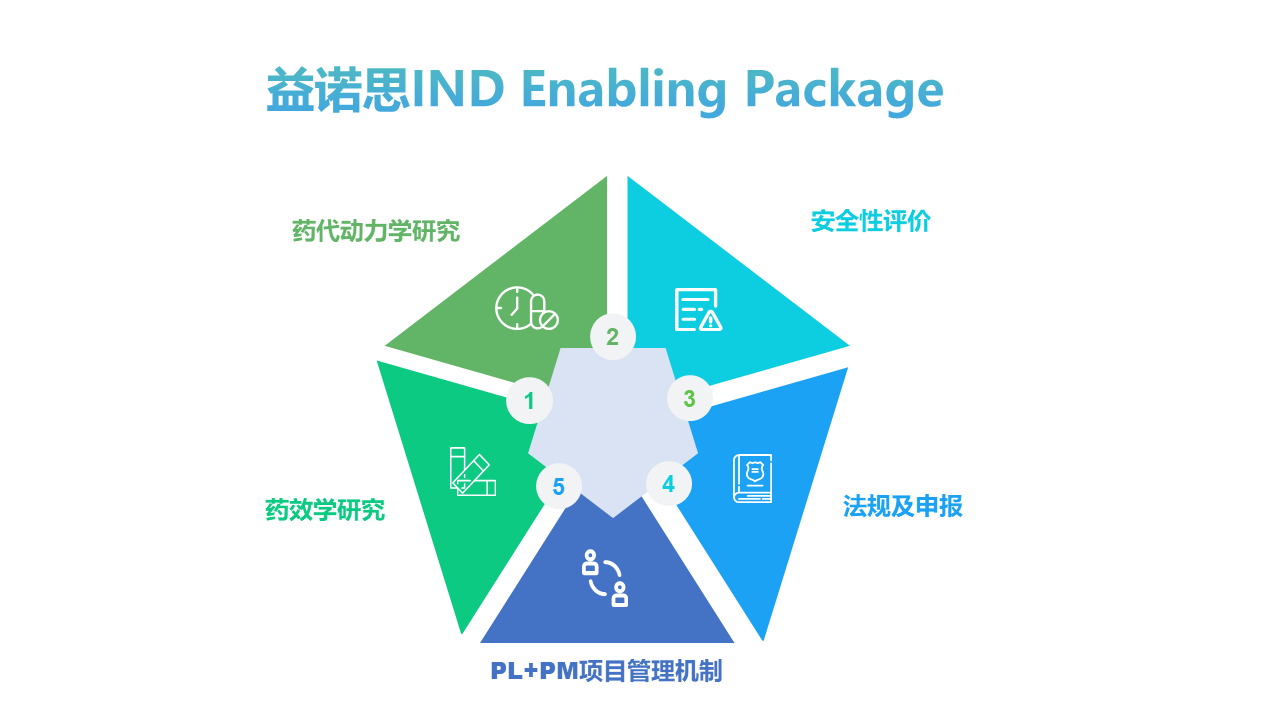
益诺思专家深入了解法规政策环境以及其对药物申报的技术要求,可提供的申报咨询服务包括:中国NMPA新药临床试验申请(IND)、新药上市申请(NDA)、仿制药上市申请(ANDA);美国FDA IND、NDA/BLA、ANDA申请;欧盟国家临床试验申请(CTA)、上市申请(MAA)、DMF和仿制药申请等。同时,可提供2.4+2.6非临床药理毒理学综述撰写服务,助力申报。益诺思助力申报并审评审批的项目数量快速增长,且广泛药物研发类型、作用靶点及治疗领域,尤其在创新品类屡创佳绩,先后助力诸多个国内、国际首创项目的顺利获批。
Provantis
益诺思使用Provantis系统进行毒理学数据采集,实现从供试品接收到最终报告生成全过程中任何阶段的数据分析和共享。其中,普通毒理学集成式模块具备了当今现代研究设计所需的灵活性,为毒理学研究在物种、给药持续时间或不同给药途径的各种类型提供支持,并可进行临床病理仪器管理、样本请求和相关结果数据;生殖毒理学相关模块为生殖毒理学研究开展各类研究活动提供支持,包括ICH方案、毒代研究、发育毒性、行为和发育神经毒性研究。
SEND数据
自2017年12月17日,FDA最新颁布的针对电子化法规申报的SEND要求开始实施。所有机构都必须使用相应的FDA所支持的标准、格式以及在FDA数据标准目录中定义的针对NDA、ANDA和特定BLA申报的术语。此外,一些被法规新采纳的试验类型如安全药理和生殖毒理,也已经被添加到SEND中。 益诺思引进了Instem公司的Submit平台解决方案,包含了一整套工作流,包括创建和管理SEND数据集合相关文档的工具和服务;与Provantis系统无缝对接,实现SEND进入数据存储库和直接向法规机构提交数据。截止2022年底,已积累140+项目完成经验。
截止2022年11月末,益诺思累计服务国内外600 余家制药公司、新药研发机构和科研院所。累计完成7,300 余项临床及非临床评价专题研究服务,其中,按照国际标准完成2,200 余项非临床评价专题研究服务,完成710 余套创新药物的非临床评价项目(包括药代、安全性评价等),并成功助力国内创新药研发NDA/BLA 成功案例13 例,IND 注册成功案例逾230例,同时协助50 余个创新药获批了美国、欧盟、韩国及澳洲等国外监管机构的注册申报。
Copyright © 2017-2021©Shanghai Innostar Biotechnology Co., Ltd. All Rights Reserved. Created By VPABrand.com